יום הסרטן הבין-לאומי 2024
חוקרים בטכניון מציגים שיפור משמעותי בניבוי הצלחתם של טיפולים אימונותרפיים
הטכנולוגיה שפיתחה קבוצת המחקר של פרופ’ יובל שקד נרשמה כפטנט וכעת היא נמצאת בתהליך מסחור
חוקרים בפקולטה לרפואה ע”ש רפפורט בטכניון גילו תאי דם חדשים המנבאים את הצלחת הטיפול האימונותרפי. הממצאים צפויים לייעל את התאמת הטיפול למטופל הספציפי, וחשיבותם נובעת מכך שחשוב מאוד לזהות מראש את החולים המגיבים לטיפול. את המחקר שפורסם בכתב העת היוקרתי Cancer Cell הובילו, בתרומה שווה למחקר ולמאמר, ד”ר מדלן בן גיגי והפוסט-דוקטורנט ד”ר טים קופר בהנחיית פרופ’ יובל שקד מהפקולטה לרפואה ע”ש רפפורט. מדובר במחקר תרגומי המתבסס על ריצוף RNA (scRNA-seq), אנליזה של מידע קיים, מודלים פרה-קליניים של סרטן ואישוש הממצאים בבני אדם.
אימונותרפיה נחשבת לאחת המהפכות הגדולות בטיפול בסרטן. היא מבוססת על ההבנה שמערכת החיסון הטבעית מצטיינת בתקיפת תאי סרטן באופן סלקטיבי ומדויק. הבעיה היא שבמקרים רבים, הגידול הסרטני משטה בה ומונע ממנה לזהותו כאויב וכך חומק ממנה. במקרה כזה, גורסת האימונותרפיה, במקום לתקוף את הסרטן בתרופות כימותרפיות הפוגעות גם ברקמות הבריאות, מוטב לסייע למערכת החיסון בזיהוי התאים הסרטניים כאויב ולתת לה לעשות את שאר העבודה בעצמה.
למרות ההצלחה המסחררת של הגישה האימונותרפית בטיפול בסרטן, יעילותה עדיין מוגבלת מאוד לכ-40% מן המטופלים. פירוש הדבר הוא שמטופלים רבים מקבלים טיפול קשוח זה ללא תוצאות חיוביות. מכאן הצורך החשוב בהבנה מעמיקה של תגובות ביולוגיות לטיפולים כאלה ובאיתור סמנים ביולוגיים המנבאים היטב את הצלחתו העתידית של הטיפול. סמנים ביולוגיים (biomarkers) הם מרכיב חשוב בעידן הרפואה המותאמת אישית. הם מאפשרים לקבל החלטות רפואיות מושכלות ולגבש מתווה טיפולי מיטבי המותאם לחולה הספציפי ולפרופיל הרפואי שלו.
כיום כבר נעשה שימוש בסמנים ביולוגיים בטיפולים אימונותרפיים, אולם אלה נלקחים בביופסיה – תהליך העלול לסכן את המטופל. בנוסף לכך, גישה זו אינה מתחשבת מספיק בפרופיל החיסוני של המטופל הספציפי וכושר הניבוי שלה לוקה בחסר, בלשון המעטה. מסיבה זו, מחקרים רבים בתחום, הן בתעשייה והן באקדמיה, חותרים למציאת דרכים חדשות לנבא מיהם החולים שיגיבו לטיפול האימונותרפי.
ומכאן – למחקר עצמו
חוקרי הטכניון, שהתמקדו באימונותרפיה מבוססת נוגדנים, גילו סמנים ביולוגיים המנבאים את תגובתו של המטופל הספציפי לטיפול. מאחר שסמנים אלה מצויים בדם, הם אינם מצריכים לקיחת ביופסיה מהגידול – תהליך פולשני שלעתים אינו ישים ולעתים, כאמור, מסכן את המטופל.
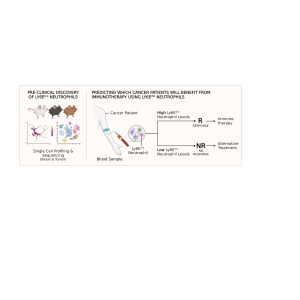
באופן סכמטי, המנגנון שגילו החוקרים הוא זה: חלבון בשם STING, המפעיל את מערכת החיסון, נכנס לפעולה נוכח התפתחות סרטנית, ומבוטא ביתר בעיקר בתאי סרטן אשר יגיבו לטיפול האימונותרפי. חלבון זה מביא לביטוי של חלבון אינטרפרון שבתורו מעורר נויטרופילים להתמיין לסוג מסוים (המבטא חלבון Ly6Ehi). נויטרופילים אלה פועלים באופן ישיר על מערכת החיסון ומעוררים אותה כנגד הגידול הסרטני.
לכן הסיקו החוקרים כי בדיקה של רמות נויטרופילים מסוג Ly6Ehi בדם החולה יכולה לשמש סמן ביולוגי יעיל בניבוי התגובה לטיפול האימונותרפי. את הממצאים אלה, שהתבססו על מחקר פרה-קליני, בחנו החוקרים על חולי סרטן (ריאות ומלנומה), תוך הצלבה עם רשומות קיימות, והדגימו את יכולתם של הנויטרופילים לנבא גם בבני אדם תגובה של מטופלים לאימונותרפיה בדיוק גבוה.
החוקרים גילו כי מעבר לערכם כסמנים ביולוגיים חשובים, הנויטרופילים עשויים גם לסייע בטיפול עצמו. נוכחות של נוירופילים אלו בגידול, יוצרים רגישות גבוהה יותר לטיפול האימונותרפי. ממצאים אלה עולים בקנה אחד עם אנליזה של מידע קיים על 1,237 מטופלי סרטן שעברו טיפולים אימונותרפיים מבוססי נוגדנים. החוקרים מצאו כי ברוב הדגימות מאותם מטופלים נמצא קשר בין רמות הנויטרופילים לתגובת המטופל לאימונותרפיה.
הטכנולוגיה שפיתחה קבוצת המחקר של פרופ’ יובל שקד נרשמה כפטנט וכעת היא בתהליך של מסחור (tech transfer) עם חברת OncoHost לטובת המשך הפיתוח. פרופ’ שקד מציין כי הטכנולוגיה ניתנת לשימוש במכשיר הנפוץ FACS, הנמצא כמעט בכל בית חולים ומאושר על ידי הרשויות הרגולטוריות.
במחקר השתתפו קבוצות מחקר שונות בארץ ובעולם ובהן רופאים וחוקרים מהדסה, רמב”ם, שיבא, אוניברסיטת חיפה, אוניברסיטת היידלברג (גרמניה) ואוניברסיטת ייל (ארצות הברית).
המחקר נתמך על ידי הנציבות האירופית למחקר (מענק ERC), הקרן הלאומית למדע, מכוני הבריאות האמריקאים (NIH), קרן אריאן דה רוטשילד (מלגת אריאן דה רוטשילד לדוקטורנטיות מצטיינות) ומלגת RTICC-Rubinstein מטעם מרכז ברוך ורות רפפורט לחקר משולב של הסרטן בטכניון.
בתרשים, משמאל לימין: תהליך הבדיקה עד להחלטה אם הטיפול האימונותרפי מתאים למטופל
למאמר ב- Cancer Cell לחצו כאן