יום הסרטן הבינלאומי 2022 – להרוויח מהטיפול, לצמצם את השלכותיו השליליות
גרורות סרטניות, גורם התמותה העיקרי מסרטן, נוצרות לעתים דווקא בעקבות טיפול כימותרפי מוצלח. קבוצת מחקר בפקולטה לרפואה ע"ש רפפורט ניתחה את התופעה האמורה והדגימה דרכי התערבות העשויות לבלום אותה
מחקר שנערך בפקולטה לרפואה ע”ש רפפורט בטכניון שופך אור על מנגנונים המובילים לכך שאפילו טיפול כימותרפי מוצלח עשוי להוביל להתפתחות גרורות סרטניות – גורם התמותה העיקרי מסרטן. המאמר, שראה אור לפני ימים ספורים בכתב העת Cancer Research, נבחר לפרסום על שער הגיליון וזכה גם למאמר דעה של עורכי כתב העת בפתח הגיליון.
פרופ’ יובל שקד והדוקטורנטית ג’וזפינה חאג’ שומלי, שהובילו את המחקר, מסבירים כי הפרקטיקות הקיימות לטיפול בסרטן מפגינות יעילות רבה ובמקרים רבים מצילות חיים, כפי שהודגם הן במחקרים קליניים והן בנתונים המצטברים לאורך שנים. עם זאת, הם אומרים, יש חולים שאינם מגיבים לטיפול, ולעיתים המחלה מתפרצת לאחר הטיפול ביתר אגרסיביות, לרבות גרורות באיברים אחרים כגון הריאות. המאמר מסביר את המנגנון הגורם להתפרצות גרורות לאחר טיפול גם במקרים שבהם הטיפול פוגע בהצלחה בגידול הראשוני.
החוקרים התמקדו בהתפתחות של גרורות ברקמת הריאות בעקבות טיפול כימותרפי בסרטן השד. סרטן השד הוא הגידול הממאיר השכיח ביותר בקרב נשים והוא מתרחש, בשיעור נמוך, גם בגברים. שיעורי ההישרדות של חולים אלה בישראל הולכים וגדלים הודות לגילוי מוקדם של המחלה ולשיפור של טכנולוגיות הטיפול. עם זאת, כאשר הגידול שולח גרורות לאיברים אחרים, סיכויי ההחלמה צונחים. על פי הסטטיסטיקה, בכ-30% מהמטופלות שאובחנו בסרטן שד בשלב מוקדם, וטופלו באמצעים קונוונציונליים, צפויות להתפתח גרורות תוך חודשים ספורים או שנים ספורות.
גרורות שמקורן בסרטן שד נובעות בין השאר מקרבתו של השד לקשריות הלימפה בבתי השחי. סמיכות זאת מקילה על תאים סרטניים להגיע מהשד למערכת הלימפה, שהיא מערכת צינורות מסועפת הדומה במידה רבה למערכת הדם. דרך נוזל הלימפה נודדים תאי הסרטן לאיברים אחרים כגון ריאות, כבד ועצמות, ושם הם מייצרים גרורות.
השאלה המעסיקה חוקרי סרטן רבים, על רקע זה, היא אילו תנאים מסייעים לתהליך הגרורתי ואילו התערבויות רפואיות עשויות לבלום אותו. לדברי פרופ’ שקד, “כיום ידוע שהתהליך הגרורתי אינו אקראי לגמרי. הגרורות משגשגות ברקמות שבהן הן מוצאות תמיכה מכנית וסביבת תאים תומכת.”
קבוצת המחקר של פרופ’ שקד גילתה במחקרים קודמים כי אנזים שכיח בשם LOX, המשפיע על תצורת הרקמה, עשוי לשנות את רקמת הריאות באופן המקל על תאים סרטניים להיצמד אליה ולפתח בה גרורות. כאשר עיכבו החוקרים את פעילותו של אותו אנזים הושגה הפחתה משמעותית ביכולת ההיצמדות של תאי הסרטן לרקמת הריאה וכך פחתה היווצרותן של גרורות סרטניות. גם במחקר הנוכחי התמקדו החוקרים באנזים LOX, אולם הפעם בהקשר אחר – מעורבותו בהתפתחות גרורות בעקבות הפרשתו מתאי חיסון ספציפיים: תאי T מסוג CD8+. אנזים LOX נמצא במינון גבוה ברקמות הריאה גם באדם הבריא, אולם מינון זה גדל באופן מהיר ודרמטי בתגובה לטיפול הכימותרפי. בניגוד לסברה הרווחת, לפיה אנזים זה מתבטא בתאים מזנכימליים, חוקרי הטכניון גילו להפתעתם כי המינון המוגבר של LOX נובע דווקא מהפרשתו המוגברת על ידי תאי מערכת החיסון – אותם תאי T מסוג CD8+. העלייה בנוכחותו של אנזים זה משפיעה על תכונותיה של רקמת הריאה והופך אותה לסביבה המיטיבה עם תאי סרטן. תופעה זו יכולה להסביר מדוע במטופלים מסוימים העוברים כימותרפיה מתפתחות גרורות אפילו בעקבות טיפול ראשוני מוצלח. ההסבר, כאמור, הוא בהשפעת הכימותרפיה על רקמת הריאות באופן שרקמה זו נעשית נוחה עבור תאי סרטן.
“כשאנחנו מדברים על סביבת הריאה במחקר הזה,” מסביר פרופ’ שקד, “אנחנו מתייחסים ל-ECM, הסביבה החוץ-תאית שבתוכה שרויים התאים. זוהי רשת מורכבת של חלבונים התומכת בתא מבחינה מבנית ומכנית כמו גם מבחינת היבטים תפקודיים שונים. במחקר הנוכחי גילינו כי פעילותו של LOX רותמת את הסביבה החוץ-תאית לטובת התאים הסרטניים. בעקבות השינויים שתאי ה-T ואנזים LOX מחוללים בתווך הזה הוא מתחיל לסייע לתאים הסרטניים לגדול, לשרוד, לנוע, להתחלק ולהיצמד זה לזה. יתר על כן, הוא עשוי לבלום כניסה של תאי חיסון תקינים ואפילו של תרופות אנטי-סרטניות לאזור הממאיר.”
המחקר נערך במודל של סרטן השד בעכברים ובתרופה האנטי-סרטנית פּאקליטקסל, אולם החוקרים מעריכים כי ממצאיו רלוונטיים גם לתרופות נוספות ולסוגי סרטן אחרים, מה שצפוי להיבדק בעתיד במחקרים קליניים. לדברי הדוקטורנטית ג’וזפינה חאג’ שומלי, “הופתענו לגלות שמנגנוני הפעולה שחשפנו, המעודדים התפתחות של גרורות סרטניות, מופעלים לא רק בתגובה לניתוחים כמו שנמצא בעבר, אלא גם בתגובה לכימותרפיה ואולי לתרופות נוספות שאותן אנו חוקרים כעת.”
“ההישג שלנו – איתור המנגנון הגורם לשינוי המבני בריאה על ידי מערכת החיסון – עשוי לאפשר לפתח תרופות וטיפולים משולבים שימנעו תופעה זו ויצמצמו את הסיכויים להתפתחות גרורות,” אומר פרופ’ שקד. “כעת אנחנו שוקדים על פיתוח חסמים לחלבונים השונים הגורמים לאותה השתנות מבנית של רקמת הריאה. אנחנו מאמינים כי ממצאי המחקר יובילו להגדרה מעודכנת של בנק המטרות הטיפולי ולשימוש במעכבי LOX לבלימת התפתחויות גרורתיות.”
המחקר נתמך על ידי BSF (הקרן הדו לאומית ארה”ב-ישראל למדע), ERC (הנציבות האירופית למחקר) ו-ISF (הקרן הלאומית למדע בישראל). הדוקטורנטית ג’וזפינה חאג’ היא מלגאית בתוכנית אריאן דה רוטשילד לתלמידות דוקטורט – תוכנית המקדמת דוקטורנטיות מצטיינות לטובת השתלבותן בעמדות מפתח באקדמיה ובחברה הישראלית.
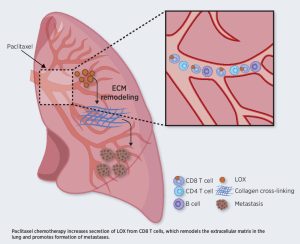
בתרשים: הטיפול הכימותרפי מגביר את הפרשת LOX מתאי T, ובעקבות זאת משתנה הסביבה החוץ-תאית בריאות באופן המעודד היווצרות גרורות
למאמר המדעי בכתב העת Cancer Research לחצו כאן




